 DEMOCRITO
DEMOCRITO
Demócrito fundó la doctrina atomista, que concebía
el universo constituido por innumerables corpúsculos o
átomos sustancialmente idénticos, indivisibles, eternos e iy difieren entre sí únicamente en cuantndestructibles, que se encuentran en movimiento en el vacío infinito oa sus dimensiones, su forma y su posición. La inmutabilidad de los átomos seexplica por su solidez interior, sin vacío alguno, ya que todo proceso de separación se entiende producido por la posibilidad de penetrar, como con un cuchillo, en los espacios vacíos de un cuerpo; cualquier cosa sería infinitamente dura sin el vacío, el cual es condición de posibilidad del movimiento de las cosas existentes. el filósofo griego Demócrito consideró que la materia estaba constituida por pequeñísimas partículas que no podían ser divididas en otras más pequeñas. Por ello, llamó a estas partículas átomos, que en griego quiere decir "indivisible" Demócrito atribuyó a los átomos las cualidades de ser eternos, inmutables e indivisibles.
el filósofo griego Demócrito consideró que la materia estaba constituida por pequeñísimas partículas que no podían ser divididas en otras más pequeñas. Por ello, llamó a estas partículas átomos, que en griego quiere decir "indivisible" Demócrito atribuyó a los átomos las cualidades de ser eternos, inmutables e indivisibles.
JONH DALTON
y físico británico.
En su infancia ayudaba con su hermano a su padre en
el trabajo del campo y
de la pequeña tienda familiar donde tejían vestidos.
Aunque su situación económica
era bastante humilde, recibieron
cierta educación en la escuela cuáquera más cercana.
Nunca se casó, tal vez para dedicarse tiempo completo a lo que
verdaderamente le apasionaba: la ciencia.
Con sólo 12 años de edad Jonh Dalton abrió
una escuela en su localidad natal,
después de dos años tuvo que abandonar
su proyecto debido al bajo salario.
Su hermano y él abrieron su propia escuela, donde ofrecían clases de
inglés, latín, griego y francés, además de 21 temas relacionados con las matemáticas
y las ciencias. Su hermana se trasladó con ellos para ayudarles en la casa.
| Teoría atómica de Dalton |
| 3. Los compuestos se forman al combinarse los átomos de dos o más elementos en proporciones fijas y sencillas. De modo que en un compuesto los de átomos de cada tipo están en una relación de números enteros o fracciones sencillas. 4. En las reacciones químicas, los átomos se intercambian de una a otra sustancia, pero ningún átomo de un elemento desaparece ni se transforma en un átomo de otro elemento. THORMSON
Thomson nació en 1856 en Cheetham Hill, un distrito de
Manchester en Inglaterra, y tenía ascendencia escocesa. En 1870 estudió
ingeniería en el Owens College, hoy parte de la Universidad de Manchester, y se
trasladó al Trinity College de Cambridge en 1876. En 1880, obtuvo su
licenciatura en Matemáticas (Segunda Wrangler y segundo premio Smith) y MA
(obteniendo el Premio Adams) en 1883. En 1884 se convirtió en profesor de
Física en Cavendish. Uno de sus alumnos fue Ernest Rutherford, quien más tarde
sería su sucesor en el puesto.
En 1890 se casó con Rose Elizabeth Paget, hija de Sir Edward
George Paget, KCB, un médico, y en ese entonces Regius Profesor de Medicina
(Regius Professor of Physic) en Cambridge. Con ella, fue padre de un hijo,
George Paget Thomson, y una hija, Joan Paget Thomson. Su hijo se convirtió en
un destacado físico, quien a su vez fue galardonado con el Premio Nobel de
Física en 1937 por demostrar las propiedades de tipo ondulatorio de los
electrones.
J.J. Thomson fue galardonado con el Premio Nobel de Física
en 1906, "en reconocimiento de los grandes méritos de sus investigaciones
teóricas y experimentales en la conducción de la electricidad generada por los
gases." Fue nombrado caballero en 1908 y nombrado en la Orden del Mérito
en 1912. En 1914 dio el Romanes Lecture en Oxford sobre "La teoría
atómica". En 1918 fue nombrado Rector del Trinity College de Cambridge,
donde conoció a Niels Bohr, donde permaneció hasta su muerte. Murió el 30 de
agosto de 1940 y fue enterrado en la Abadía de Westminster, cerca de Sir Isaac
Newton.
Thomson fue elegido Miembro de la Royal Society el 12 de
junio de 1884, y posteriormente fue el presidente de la Royal Society de 1915 a
1920.
Rutherford, basándose en los resultados obtenidos en sus experimentos de bombardeo de láminas delgadas de metales, estableció el llamado modelo atómico de Rutherford o modelo atómico nuclear. 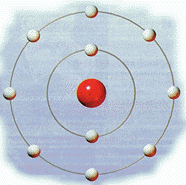 El átomo está formado por dos
partes: núcleo y corteza. El átomo está formado por dos
partes: núcleo y corteza.El núcleo es la parte central, de tamaño muy pequeño, donde se encuentra toda la carga positiva y, prácticamente, toda la masa del átomo. Esta carga positiva del núcleo, en la experiencia de la lámina de oro, es la responsable de la desviación de las partículas alfa (también con carga positiva). La corteza es casi un espacio vacío, inmenso en relación con las dimensiones del núcleo. Eso explica que la mayor parte de las partículas alfa atraviesan la lámina de oro sin desviarse. Aquí se encuentran los electrones con masa muy pequeña y carga negativa. Como en un diminuto sistema solar, los electrones giran alrededor del núcleo, igual que los planetas alrededor del Sol. Los electrones están ligados al núcleo por la atracción eléctrica entre cargas de signo contrario. enlaces: Democrito TEORIA ATÓMICA DE DEMOCRITO Jothn Dalthon Teoría atómica de Dalton Thomson Modelo atómico de Thomson |





